한눈에 보는 정보
- 크릴 오일, 아스타잔틴, 베르베린은 간의 인슐린 저항성의 반영일 수 있는 TMAO(트리메틸아민-N-옥사이드) 수치가 높은 환자에게 가장 좋은 치료제 중 하나일 수 있습니다
- 또한 체중을 정상화하는 것이 좋습니다. 이것에 관련하여 가장 도움이 되는 두 가지 전략은 주기적인 키토제닉 식단과 간헐적인 단식입니다
- TMAO는 계란과 고기와 같은 동물성 식품에서 나오는 카르니틴과 식이 콜린의 대사물입니다. 일부 연구는 TMAO 증가가 심혈관 질환의 위험 요인일 수 있다고 제안합니다
- 가장 풍부한 공급원 중 하나가 생선인 TMAO 또는 그 전구체의 식이 섭취를 제안할 증거는 사실상 없으며, 신장 기능이 정상이라면 실제로 심혈관 질환을 촉진합니다
- TMAO 수치 상승의 진정한 원인은 간 인슐린 저항성입니다. 간 기능이 저하되면 FMO3가 증가하여 TMAO가 크게 증가하는 것으로 나타났습니다
Dr. Mercola
최근 몇 년 동안, 연구는 TMAO(트리메틸아민-N-산화물)가 인슐린 저항성 및 위장암의 치료 대상이 될 수 있다고 제안했습니다. 2017년의 한 과학 검토에서는 다음과 같이 언급했습니다.
"동물 단백질과 동물 제품의 다른 성분들의 소화를 통해, 장내에 있는 공생 박테리아는 인슐린 저항성과 암의 발달에 기여할 수 있는 대사산물을 형성합니다.
TMAO(트리메틸아민-N-산화물)는 그러한 분자이며, 최근에 장내 미생물과 심혈관 및 신장 질환의 위험 인자이자 연관성이 있을 수 있기 때문에 많은 관심을 끌고 있습니다.
또한, TMAO는 인슐린 저항성을 포함한 다른 바람직하지 않은 조건에 대한 생물학적 지표로, 또는 심지어 독립적인 위험 인자로 중요할 것으로 예상됩니다 ... TMAO는 주로 섭취된 음식으로부터 얻어지는 콜린과 카르니틴과 같은 다양한 전구체의 대사산물인 트리메틸아민(TMA)에서 유래합니다."
필자의 책 ‘착한 지방 악한 지방 팩트체크’의 공동 저자이기도 한 제임스 디니콜란토니오(James DiNicolantonio)가 이끄는 논문에서, 우리는 심혈관 질환의 증가 위험과 관련된 TMAO 수치 상승의 진정한 원인일 수 있는 간 인슐린 저항성을 보여줍니다.
게다가 이 논문은 크릴 오일, 아스타잔틴, 피쉬 오일, 베르베린은 TMAO 수치가 높은 사람들에게 식단 최적화 후 최고의 보충 전략이 될 수 있다는 것을 보여줍니다. TMAO 수치가 단순히 간의 인슐린 저항성의 반영이기 때문입니다.
디니콜란토니오는 제이슨 펑(Jason Fung) 박사와 함께 피쉬 오일과 크릴 오일을 포함한 오메가-3의 이점에 대해 깊이 연구하는 ‘어떤 몸으로 나이 들 것인가’이라는 책을 출간했습니다.
TMAO 수치 상승의 원인은 무엇일까요?
앞서 언급했듯이, 몇 가지만 예로 들어, 계란, 간, 고기, 생선에서 발견되는 식이 콜린과 카르니틴을 위장 박테리아가 대사할 때 TMAO가 생성됩니다. 박테리아는 콜린과 카르니틴을 트리메틸아민으로 바꾸고, 트리메틸아민은 그 후 여러분의 간에서 주로 FMO3인 플라빈 모노산소첨가효소의 도움으로 TMAO로 흡수되고 산화됩니다.
플라빈 모소산소첨가효소는 제노 기질(xenosubstrate)을 산화시켜 화합물이 배설되도록 하는 효소의 한 계열입니다. 콜린과 카르니틴은 심혈관 질환과 제2형 당뇨병의 위험 인자로 여겨지는 TMAO를 증가시키기 때문에, 일부 사람들은 이러한 영양소의 식사와 보충제 섭취를 제한할 것을 권고합니다.
하지만 디니콜란토니오와 그의 공동 저자들은 이 이론에 중대한 결함이 있다고 다음과 같이 지적합니다.
"영양 역학은 식이 콜린을 심혈관 위험 인자로 죄를 뒤집어 씌우는 데 실패했습니다. 보충적 카르니틴은 혈관 질환이 있는 환자에게 매우 보호적 기능을 갖고 있는 것으로 알려져 있습니다. 그리고 사전 형성된 TMAO의 가장 풍부한 식이 공급원인 생선 또한 보호적입니다.
따라서, TMAO는 적어도 심각한 신장 기능 장애가 없는 사람들에게서 보이는 적당한 농도에서라면 혈관 질환의 매개 위험 인자가 아니라, 혈관 질환과 당뇨병을 촉진하는 인자들의 지표로 작용합니다.
신장 기능의 손상은 이러한 요인들 중 하나이지만, 유일한 요인인 것은 아닙니다. 트리메틸아민을 생성하는 데 능숙한 특정 GI 박테리아가 혈관 및 대사 건강에도 해로울 가능성은 문서화되지 않은 상태로 남아 있습니다. 따라서 간의 FMO3를 증가시키는 요인은 의심의 대상이 됩니다.
실제로 간 인슐린 저항성과 관련된 비정상적인 간 인슐린 활동은 간 FMO3 발현을 증가시킵니다. 간 인슐린 저항성은 대사 증후군과 내장 비만으로 인해 발생할 수 있으며, 심혈관 질환과 당뇨병에서 매개 역할을 할 수 있는 아디포넥틴 또는 글루카곤 유사 펩타이드-1의 차선의 활동을 반영할 수 있습니다.
따라서 간 인슐린 저항성과 싸우는 식단, 영양제 및 약물은 TMAO 증가와 관련된 건강 위험을 완화하는 데 유용할 수 있습니다."
TMAO 증가는 심혈관 질환 및 대사 질환의 위험 요소인가요?
특집 기사에서 언급한 바와 같이, 상승된 TMAO와 심혈관 질환 위험을 연결하는 증거는 엇갈립니다. 몇몇 연구들은 TMAO의 증가된 혈중 수치가 기존에 심장 질환을 가지고 있는 사람들의 주요 심장 혈관 사건을 예측하는 반면, 다른 사람들은 이러한 연관성에 대한 지지를 찾지 못했다고 결론지었습니다.
그럼에도 불구하고, 2018년에 발표된 11개의 연구에 대한 메타 분석은 더 높은 TMAO 수준이 심혈관 사건에 대한 위험을 23% 증가시키고 모든 원인 사망률을 55% 증가시키는 것과 관련이 있다는 것을 발견했습니다.
디니콜란토니오의 논문에서 인용된 동물 연구는 또한 TMAO 또는 그 전구체인 포스파티딜콜린과 카르니틴의 매우 높은 경구 투여가 친아테로제닉 효과를 가질 수 있음을 시사합니다.
사례 통제 역학 연구는 또한 높은 TMAO를 제2형 당뇨병 및 대사 증후군의 위험이 크게 증가하는 것과 연관시켰습니다. "TMAO와 당뇨병 위험 사이의 상관관계는 TMAO와 심혈관 위험의 상관관계보다 더 강한 것으로 보입니다."라고 디니콜란토니오는 쓰고 있습니다.
그리고, 신장 기능이 정상이라면 TMAO 또는 그 전구체의 식이 섭취가 심혈관 질환을 실제로 촉진한다는 증거는 아주 적습니다. 반대로 콜린은 뇌, 신경계, 심혈관 기능뿐만 아니라 건강한 간 기능과 해독에도 중요합니다.
실제로, 그것은 지방간 질환 예방에 필수적인 것으로 보이며, 부분적으로 긴 사슬 오메가-3 지방의 이점 때문에 심혈관 질환에 이로운 영향을 미치는 것으로 알려진 생선과 같은 음식에서 많은 양이 발견됩니다. 디니콜란토니오는 다음과 같이 씁니다.
"카르니틴 및 심혈관 위험과 관련하여, 최근 심근 경색을 경험한 환자의 예상 임상 시험에 대한 메타 분석은 카르니틴 보충이 총 사망률, 심실 부정맥 및 새로 발생한 협심증과 관련하여 현저하게 보호한다는 결론을 내렸습니다 ...
임상 실험에서도 협심증, 간헐적 파행증 및 심부전에 대한 카르니틴 또는 카르니틴 에스터 보충제의 긍정적인 효과가 보고되었습니다.
더욱이, 임상적으로 사용되는 보충 용량에 합리적으로 비례하는 용량의 카르니틴이 투여된 설치류 아테롬 발생 연구는 TMAO를 증가시키는 경향에도 불구하고 카르니틴이 항아테롬발생적이라는 것을 발견했습니다 ...
따라서 적당히 높은 TMAO는 관련 심혈관 위험의 매개자라기보다는 심혈관 사건을 촉진하고 혈장 TMAO를 증가시키는 요인의 지표라고 생각하는 것이 합리적입니다."
간 기능 저하는 TMAO를 크게 증가시킵니다
디니콜란토니오에 따르면, 핵심 요인은 간의 인슐린 저항성으로 보이며, 이는 TMAO를 상당히 높이는 것으로 나타났습니다. 그는 다음과 같이 씁니다.
"TMAO는 트리메틸아민을 얻기 위해 위장관 박테리아에 의해 식이 콜린과 카르니틴이 대사될 때 발생하며, 그것은 간 플라빈 모노산소첨가효소(FMO), 주로 FMO3에 의해 흡수되고 TMAO로 산화됩니다... 간 인슐린 저항성을 가진 사람들에서 발견되는 정상 이하의 간 인슐린 활성에 의해 간 FMO3 발현을 증가시키고 이에 따라 TMAO 수치도 증가시킵니다."
디니콜란토니오는 간에서 증가된 FMO3 활성이 장기의 인슐린 저항성의 반영이 될 수 있으며, 이는 다시 심혈관 건강 위험에 영향을 미칠 수 있다고 계속해서 제안합니다. 이는 “TMAO의 역학을 합리화할 수 있다”라고 믿으며 그는 다음과 같이 설명합니다.
"간 인슐린 저항성과 그에 수반되는 일반적인 간 지방증은 심혈관 위험 증가뿐만 아니라 제2형 당뇨병 위험 증가와 관련이 있습니다(TMAO 증가와도 관련이 있는 위험).
따라서 TMAO가 간 인슐린 저항성의 지표로 작용할 수 있으며, 이것이 TMAO와 관련된 심혈관 질환 및 당뇨병 위험의 적어도 일부를 설명한다고 가정하는 것이 올바릅니다."
간에서 인슐린 저항성을 역전시키는 방법
TMAO 증가가 심혈관 질환 위험을 높이는 간 인슐린 저항성의 반영이라면, 이를 수정하고 위험을 낮추기 위해 여러분은 무엇을 할 수 있을까요? 우선, 체중을 정상화하는 것이 좋습니다.
이와 관련하여 가장 도움이 되는 두 가지 전략은 주기적인 키토제닉 식단과 간헐적인 단식입니다. 최상의 결과를 얻으려면 이 둘을 함께 수행해야 합니다. 다음과 같은 특정 영양제는 간 인슐린 저항성 치료에도 매우 유익할 수 있습니다.
- 메트포르민과 매우 유사한 기능을 하는 베르베린은 당뇨병 치료에 일반적으로 사용되는 약입니다. 둘 다 적어도 부분적으로 아데노신 1인산염 활성 단백질 키나아제(AMPK)를 활성화함으로써 작동합니다. '대사의 마스터 스위치'로 알려진 AMPK는 신체에서 에너지가 생성되는 방식과 세포에서 에너지가 사용되는 방식을 제어하는 효소입니다.
이 효소를 활성화함으로써 베르베린과 메트포르민은 지질, 포도당 및 에너지 불균형을 정상화하는 생물학적 활동을 조절하는 데 도움이 됩니다. 당뇨병을 치료하기 위해 중국 의학에서 사용되는 베르베린은 또한 당뇨병이 있는 설치류의 간 인슐린 저항성을 상쇄하는 것으로 나타났습니다.
- 강력한 카로테노이드 산화 방지제인 아스타잔틴은 콜레스테롤을 낮추는 약물인 페노피브레이트와 유사한 활성을 가진 PPAR 알파 작용제입니다. PPAR 알파 작용제는 여러분의 간에서 간접적으로 AMPK를 자극하고 지방이나 과당을 많이 섭취한 동물에서 간 인슐린 저항성을 완화하고 대사 증후군 환자에서 심혈관계 사건의 위험을 낮추는 것으로 나타났습니다.
- 크릴 오일은 또 다른 대안으로, 심장 건강을 포함한 건강에 필수적인 긴 사슬 오메가-3 지방과 함께 생물학적 가용성을 증가시키는 아스타잔틴의 에스테르화된 형태를 포함하고 있습니다. 디니콜란토니오의 논문에서는 다음과 같이 언급합니다.
"크릴 오일은 피쉬 오일과 비교할 때도 설치류의 간 지방증을 억제합니다. 이는 피쉬 오일에서는 발견되지 않는 아스타잔틴 함량 때문일 수 있습니다.
또한 피쉬 오일이 아닌 크릴 오일은 간에서 디아실글리세롤과 세라마이드 함량을 감소시킵니다. 크릴 오일의 인지질 분획은 피쉬 오일과 달리 간 포도당 생산을 감소시키는 것으로 알려져 있습니다.
따라서 생체 이용률이 높은 형태의 아스타잔틴의 공급원인 크릴 오일은 피쉬 오일에 비해 간 지방증과 간 인슐린 저항성을 줄이는 데 추가적인 이점이 있는 것으로 보입니다."
연구 결과의 개요 요약
요약하자면, TMAO 수치 상승이 제2형 당뇨병, 아테롬성 동맥 경화 및 심혈관 사건 위험 증가의 위험 요인일 수 있다는 일부 증거가 있지만, 영양 역학 연구는 TMAO가 합성되는 식이 콜린과 카르니틴의 해로운 영향을 입증하지 못했습니다.
또한 연구는 생선과 같은 TMAO의 식이 공급원이 심혈관 건강에 해로운 영향을 미친다는 개념을 지지하지 않습니다. 오히려 대조적입니다. 디니콜란토니오의 논문에서는 TMAO 상승이 실제로 심혈관 질환의 위험 요인이 될 수 있는 유일한 경우는 간 기능 저하를 동반할 때이며, TMAO 상승 자체가 간 기능 저하의 징후일 수 있다고 제안합니다.
좋은 소식은 영양 보충제의 도움으로 간 기능을 향상시키고 TMAO 수치를 낮출 수 있다는 것입니다. 베르베린, 아스타잔틴 그리고 크릴 오일이 주요한 세 가지 영양제입니다. 디니콜란토니오는 다음과 같이 씁니다.
"결론적으로, TMAO 증가와 관련된 혈관 질환 및 제2형 당뇨병의 위험 증가는 인식된 위험 인자에 대한 교정 후 간 인슐린 저항성 및 이를 유발하는 대사 인자에 의해 주로 매개된다고 의심하는 이유가 있습니다 ...
[이] 분석이 정확하다면, 내장 비만의 교정, 메트포르민이나 베르베린을 사용한 AMPK의 활성화, 페노피브레이트나 아스타잔틴을 사용한 PPAR 알파의 활성화, 피오글리타존 또는 식물성 식단 통한 아디포넥틴 생산의 증폭, 그리고 GLP-1의 생산 또는 생물 활동을 증폭시키는 임상 전략과 같은 간 인슐린 저항성을 완화시키는 다양한 조치들은 TMAO 증가를 감소시키는 동시에 이 위험 인자와 관련된 혈관 사건 및 당뇨병 위험을 감소시킬 수 있습니다. 그림 1에서 이러한 관계를 요약합니다...
중요한 것은, 이 분석이 TMAO가 일반적으로 심각한 신장 기능 장애에서 볼 수 있는 매우 높은 수준으로 직접적인 병원성일 수 있다는 가능성을 배제하지 않는다는 것입니다. 실제로 세포 배양 연구는 TMAO가 신부전 동안 이루어진 혈장 농도의 전염증일 수 있음을 시사합니다. 일반적으로 이러한 맥락에서 질소 화합물의 소비를 최소화하는 것이 현명합니다."
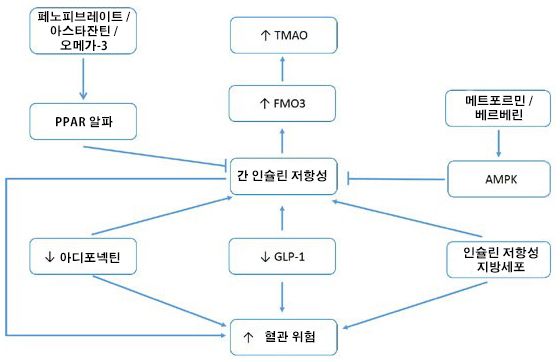
그림 1: 아디포넥틴 및 GLP-1 활성을 증가시키고, 대사 증후군을 제어하며, 간 AMPK 또는 PPAR 알파를 활성화하는 조치는 TMAO 상승 및 관련 혈관/대사 위험을 감소시킬 수 있습니다.
출처 및 참조
- Curr Pharm Des. 2017;23(25):3699-3712
- Open Heart 2019; 6: e000890 (PDF)
- N Engl J Med 2013 April 25;368(17):1575-84
- J Am Heart Assoc. 2016 Jun 10;5(6)
- PLOS ONE 2014;9(12):e114969
- Clin Chem. 2017 Jan;63(1):420-428
- J Am Heart Assoc. 2016 Oct 21;5(10)
- J Am Heart Assoc. 2015 Nov 23;4(11)
- J Cell Mol Med. 2018 Jan;22(1):185-194
- Mayo Clin Proc. 2013 Jun;88(6):544-51
- Int J Clin Pharmacol Ther Toxicol. 1985 Oct;23(10):569-72
- Arzneimittelforschung. 1992 Sep;42(9):1101-4
- J Ethnopharmacol. 2015 Feb 23;161:69-81
- Evidence-Based Complementary and Alternative Medicine 2012, article ID 591654






